CONCURSO DA TORRE DE LÍQUIDOS - 1º ANO
Os alunos do 1º ano do ensino médio da E.E.M. Francisco Holanda Montenegro participarão do CONCURSO DA TORRE DE LÍQUIDOS, organizado pelo professor de química da escola.
A participação será avaliada como trabalho para esse primeiro bimestre e será somado a pontuação de exercícios e a avaliação parcial.
O professor esclarecerá todas as dúvidas em sala e também passará as orientações devidas para os alunos.
ABAIXO VIDEO DE UMA PEQUENA TORRE DE LÍQUIDOS:
www.youtube.com/watch?v=6JCxDhOVKcM
Mãos a obra galerinha!!!
Experiências
2º ano B - mini feira de ciências - 29/11/2013
Os grupos de estudo da turma do 2º ano B irão apresentar nesse dia 29/11, sexta feira, experiências químicas que mostram reações químicas diversas, são experiẽncias simples e interessantes, toda a escola poderá acompanhar o trabalho dos jovens cientistas!!!
2º ano C- 26/03/2013 - aula prática de química
INTRODUÇÃO
Esse experimento tem por objetivo a observação da influência da pressão na temperatura de ebulição, em específico da água.
A temperatura de ebulição é uma propriedade específia dos materias, sendo essa temperatura um valor fixo a uma determinada pressão.
A pressão altera significativamente a temperatura de ebulição dos materiais, isso porque quanto maior a pressão do ambiente, maior quantidade de energia precisa ser fornecida ao líquido para que suas moléculas consigam vencer a pressão do ambiente e se desprender para a fase gasosa.
Dessa forma, quanto maior a pressão maior será a temperatura de ebulição de um material, e quanto menor a pressão menos será o valor observado para a temperatura de ebulição.
Neste experimento, vamos submeter a água em temperatura de aproximadamente 50°C a um ambiente de baixa pressão no interior da seringa, vamos observar que nesse ambiente a água entra em ebulição sem que seja necessário aquecermos mais a água, isso porque como a pressão está muito baixa, a energia necessária para água mudar de estado físico diminui tornando possivel observarmos a água ebulir em cerca de 50°C.
Com a ebulição da água, começa a existir muitas moleculas no estado gasoso, fazendo com que a pressão do interior da seringa aumente, como a pressão começa a aumentar a água no interior da seringa para de ebulir, pois com o aumento da pressão causado pelas moléculas de água no estado gasoso, faz com que seja necessário mais energia para água ebulir, como não existe fonte de aquecimento na seringa, a ebulição é cessada.
O autor do experimento é desconhecido por nós autores do vídeo. Caso você seja o autor desse experimento favor nos comunicar.
Materiais necessários
- 1 Béquer
- 1 Ebulidor
- 1 Termômetro
- 1 Seringa sem agulha
Passo 1
Aquecer a água até aproximadamente 50°C
Passo 2
Coletar um pouco da água previamente aquecida com a seringa e remover bolhas de ar caso existam
Passo 3
Tampar a entrada da seringa com o dedo
Passo 4
Puxar o êmbolo da seringa com a entrada fechada
Fotos da aula
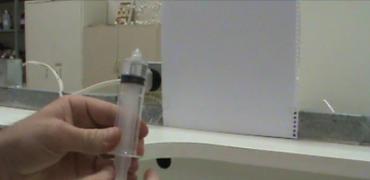


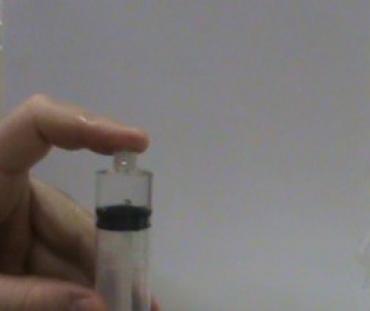
1º ano C - 26/03/2013 - aula prática de química
Professor Netto - Monitora Lidinêz
Materiais necessários
- Metanol
- Vidros de relógios
- Sais de vários metais- Use preferencialmente os cloretos
- Pipeta
- Rede de difração
Passo 1
Mãos à obra
Coloque um pouco do sal que contém o metal dentro do vidro de relógio. Para cada sal, use um vidro diferente. Pingue com a pipeta algumas gotas de metanol sobre os sais e em seguida acenda-os usando o palito de churrasco e o algodão como uma espécie de tocha.
Cuidados necessários: Use luva e óculos. Não cheire o metanol, sua ingestão ou contato com mucosas pode causar intoxicação e cegueira. Mantenha longe de qualquer fonte de calor. Produto altamente inflamável. Não use quantidades maiores que as indicadas aqui.

Passo 2
O que acontece
Este experimento é conhecido como “teste de chama”. Esta prática é muito usada em análises químicas por ser um método rápido e barato para detecção de alguns metais. Este teste baseia-se em uma das mais importantes propriedades dos elétrons, enunciada pela primeira vez por Niels Bohr. Ele disse que a energia dos elétrons é "quantizada", isto é, um elétron ocupa sempre níveis energéticos bem definidos dentro de cada átomo e não valores quaisquer de energia. Porém quando fornecemos a energia necessária para um elétron, ele pode “saltar” para um nível de maior energia. Quando o elétron é promovido a um nível de maior energia dizemos que ele se encontra no estado excitado. Porém, neste estado ele se torna menos estável e retorna quase imediatamente ao seu estado de menor energia ou estado fundamental, liberando aquela energia em forma de luz visível.
Optamos por usar na maioria dos casos os cloretos de vários metais, como pode ser visto no vídeo, pois eles possuem uma solubilidade maior no metanol. Usamos os cloretos de lítio, cobre (II), sódio, potássio e estrôncio, além de ácido bórico. O uso do metanol também é indicado porque esse produz uma chama quase invisível aos nossos olhos, o que minimiza a interferência com a cor da luz emitida pelo metal.
Usamos também uma rede de difração. Mas o que é uma rede de difração? A cada milímetro de sua superfície existem centenas de fendas paralelas e microspócicas. A luz que incide sobre a rede de difração sobfre desvios que dependem do seu comprimento de onda. Por esta razão quando as cores viajam juntas a rede promove a separação delas permitindo ainda que se identifiquem os comprimentos de ondas que contém um dado espéctro.
Fotos da aula prática






2º ano A, B e C. - Asunto: reações nucleares, radioatividade
Experiência muito intessante de como deixar um tomate fosforescente (também pode ser feito com beringela ou qualquer fruta o legume que tenha uma casca fina, ou qualquer outra coisa como mostrado no vídeo. Vejam o video (na parte de vídeos - DIVERSOS) e em seguida a tradução de como fazer. Só não vai inventar moda de comer o bagulho depois!
Consiga vários palitos de fósforo (vários mesmo), mas tem que ser palitos de fósforo puro, que tenham alta concentração de fósforo em sua extremidade, ou extermine várias caxinhas de fósforo (essas normais, caso você não ache fósforo puro), pois o elemento fósforo fica na lixa que tem na caixinha e não no palito. Pegue esses palitos de fósforo ou a linha da caixinha e raspe a parte que contém o fósforo e coloque-as em algum pilão para transformá-las em pó.
►Em um recipiente misture o pó com água sanitária (candida), acho que da pra fazer com cloro também. Misture bem e deixe descansar por uns 20 minutos.
►Você verá que formou uma mistua heterogêna, uma parte mais fina (cima) e uma parte mais grossa (baixo), com uma seringa retire a parte mais fina da mistura e injete-a no tomate.
►Agora com uma nova seringa injete um pouco de água oxigenada no tomate e está pronto seu tomate psicodélico.
O que ocorre é um processo acelerado de oxidação pela reação do hipoclorito de sódio com o peróxido de hidrogênio e fósforo que faz com que uma reação atômica ocorra, jogando elétrons para fora das órbitas (TOERIA ATÔMICA DE BOHR sobre os saltos do elétrons). gerando um belo efeito visual. É este o processo que faz aqueles glow stickers de boates e festas de aniversário brilharem tanto.
Dados da Aula
O que o aluno poderá aprender com esta aula
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Estratégias e recursos da aula
Geralmente, o tópico: Tabela Periódica, tem sido considerado, pelos alunos, como monótono e repetitivo. Para romper com essa aparente monotonia e fazer com que o aluno vivencie o assunto e incorpore o aprendizado, foi proposto um trabalho onde estes deveriam construir uma Tabela Periódica utilizando a borracha E.V.A.
O trabalho foi proposto da seguinte forma: cada aluno, de turmas de quarenta alunos cada, ficou responsável pela confecção em E.V.A de 2 ou 3 elementos químicos e pela pesquisa sobre os respectivos elementos. A seqüência de distribuição dos elementos químicos entre os alunos obedeceu à lista de chamada.
Cada um dos elementos químicos teve uma área reservada de 100 cm2 , em cores de E.V.A. previamente definidas. Cada quadrado deveria constar o símbolo do elemento com o respectivo número atômico e massa atômica.
Foram escolhidas as seguintes cores para a confeção da Tabela Periódica:
Hidrogênio - cinza
Metais alcalinos – laranja
Metais alcalinos terrosos – vermelho
Elementos de transição – amarelo
Famílias, 13, 14 e 15 – branco
Calcogênios – lilás
Halogênios – verde
Gases Nobres- azul
Lantanídeos e Actinídeos – rosa
As amostras das cores foram disponibilizadas para os alunos com antecedência, para se evitar diferenças de tonalidades nas cores previamente escolhidas. Os símbolos foram escritos com pincel atômico preto, assim como os números atômicos e as massas atômicas.
A Tabela Periódica foi montada em uma parede no interior de cada uma das salas de aula. A montagem da tabela foi iniciada com o elemento hidrogênio, seguido do lítio, sódio e potássio. Depois o berílio, o magnésio e o cálcio, seguido de todos os outros elementos do quarto período. A partir desse início, um pouco mais orquestrado, os outros elementos foram adicionados, sendo que os actinídeos e os lantanídeos ficaram por último.
As tabelas montadas pelos alunos ficaram bastante atraentes e foram usadas ao longo do ano letivo como recurso didático.
Avaliação
_________________________________________________________________________________________________________________________________
OBJETIVOS: Observar evidências de calor envolvidas na oxidação do ferro.
MATERIAL: 2 termômetros, vinagre, 2 bequers, palha de aço (BomBril) e elástico.
PROCEDIMENTO: Todos os materiais utilizados devem estar a mesma temperatura antes da experiência. Para isso, deixe-os em um mesmo local,
por pelo menos, uma hora.
Mergulhe um pedaço de palha de aço no vinagre, por um minuto. Retire-o, escorra o excesso de líquido, envolva o bulbo de um dos termômetros com ele e prenda-o com o elástico. Coloque esse termômetro em um dos bequers e o outro termômetro no bequer restante.
Registre a temperatura em cada termômetro e volte e volte a registra-la a cada 2 minutos, por um intervalo de 10 minutos.
Analise as anotações feitas. O que se pode notar? Como isso pode ser explicado?
Fonte: Química na abordagem do cotidiano - volume 2. ed. Moderna - Francisco Miragaia Peruzzo e Eduardo Leite do canto.
EXPERIÊNCIAS
OBJETIVO: Estudar sistemas de aquecimento de água em "banho-maria".
MATERIAL: Um béquer de 50 ml, um tubo de ensaio, um tripé, uma tela de amianto, uma lamparina ou algo similar, um suporte com garra, dois termômetros.
PROCEDIMENTO: Colocar agua no bequer, colocar o béquer sobre o tripé com a tela de amianto. Introduzam agua no tubo de ensaio até um terço de sua altura, aproximadamente. Usando o suporte e a garra, prendam esse tubo de ensaio de modo que ele fique mergulhado na agua do béquer sem encostar no fundo do béquer. Observar se a agua no tubo de ensaio esta no mesmo nível ou um pouco abaixo do nível da agua no béquer.
Acender a lamparina ou similar e colocar o termômetro no tubo de ensaio e outro no béquer.
Observem o sistema até que a agua do béquer comece a ferver. Anotem a temperatura da água no béquer e a do tubo de ensaio. Observe a agua no tubo de ensaio depois de 5 minutos do ínicio da ebulição da agua do béquer e anotem sua temperatura. Aguardem mais 5 minutos e observem novamente a agua no tubo de ensaio.
Fonte: Química - volume 2. ed. scipione - eduardo Fleury e Andréa Horta.

